Copy link
Tetralogía de Fallot
Last updated: 01/08/2025
Puntos Importantes
- La Tetralogía de Fallot es la cardiopatía congénita cianótica más frecuente, caracterizada por 4 anomalías cardíacas: comunicación interventricular (CIV), obstrucción del tracto de salida del ventrículo derecho (OTSVD), hipertrofia del ventrículo derecho, y cabalgamiento de la aorta sobre la CIV
- Objetivos fisiológicos incluyen: 1) mantener la postcarga del ventrículo izquierdo y resistencia vascular sistémica (RVS) para reducir el shunt de derecha a izquierda por la CIV y promover el flujo sanguíneo hacia el territorio pulmonar, y 2) minimizar la obstrucción dinámica del TSVD manteniendo una precarga adecuada y evitando episodios de estrés y taquicardia
- Consideraciones anestésicas incluyen la prevención de episodios de crisis cianóticas mediante la mitigación de factores desencadenantes como agitación y dolor que conducen al espasmo infundibular, y evitando la disminución de la RVS. El tratamiento de las crisis incluye aumentar la RVS con un vasoconstrictor (fenilefrina), bolo de suero intravenoso, adecuada sedación, oxígeno al 100%, y el uso de beta-bloqueadores
Introducción
La tetralogía de Fallot (TOF) es la cardiopatía cianótica más frecuente, resultante del subdesarrollo infundibular, dando lugar a las 4 anomalías cardíacas características,1 figura 1:
1. Comunicación interventricular (CIV)
2. Obstrucción del tracto de salida del ventrículo derecho (OTSVD) con dos componentes:
- Fijo: valvular, subvalvular, y/o supravalvular, del tronco de la arteria pulmonar o de las ramas pulmonares
- Dinámico: espasmo infundibular
3. Hipertrofia del ventrículo derecho
4. Cabalgamiento de la aorta sobre el CIV
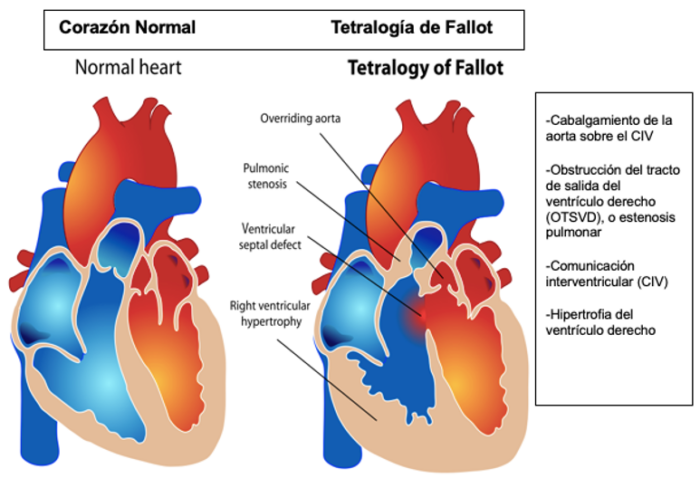
Figura 1. Las cuatro anomalías cardíacas características de la tetralogía de Fallot. Original por Mariana Ruiz Ladyofhats. Public domain: Link
Existe un amplio espectro de gravedad y clínica en los pacientes con TOF dado por la magnitud de la OTSVD, que va desde un TOF rosado caracterizado por una CIV amplia con OTSVD leve que presenta shunt de izquierda a derecha, hasta la atresia pulmonar en que el flujo pulmonar está dado sólo por un ductus arterioso persistente (DAP) o colaterales aortopulmonares mayores (MAPCAs).
La presentación y el abordaje quirúrgico de la TOF con estenosis pulmonar es diferente a la TOF con atresia pulmonar debido a la presencia de MAPCAs.1 Otra variante, la TOF con válvula pulmonar ausente también tiene implicancias diferentes. Por tanto, este artículo se centrará en la presentación más típica: el paciente con TOF y estenosis pulmonar.
Fisiopatología
Embriológicamente, Van Praagh postula que la TOF es el resultado del desarrollo anormal del infundíbulo.2 Existe una desviación anterior y cefálica del septum infundibular. Este desplazamiento genera las anomalías características de esta entidad.
Al quedar los componentes infundibular y muscular del septum interventricular desalineados dan origen a la CIV. Al mismo tiempo la aorta se desplaza hacia la derecha, anterior y superiormente, resultando en la orientación de la válvula aortica sobre la CIV, o cabalgamiento de la aorta sobre el CIV.2
La hipertrofia del ventrículo derecho ocurre como consecuencia de la eyección contra una postcarga elevada, debido a la presión sistémica transmitida del ventrículo izquierdo por la CIV y a la OTSVD.
Cuando la OTSVD es severa se produce un shunt o derivación del flujo de sangre por la CIV de derecha a izquierda, disminuyendo el flujo pulmonar (Qp:Qs <1; Qp, flujo pulmonar; Qs, flujo sistémico), lo que resulta en cianosis.
La fisiopatología de la crisis cianótica será descrita más adelante.
Presentación clínica
La presentación clínica de la TOF varía con la características anatómicas específicas del paciente y el grado de obstrucción del TSVD. La ecocardiografía transtorácica es el método diagnóstico de elección para los pacientes con TOF.3
Los recién nacidos con TOF y obstrucción severa del TSVD pueden cursar con hipoxemia severa y encontrarse en estado crítico al momento de la presentación. Estos pacientes son dependientes del ductus arterioso para mantener el flujo de sangre hacia los pulmones; por lo que requieren prostaglandinas para mantener el ductus abierto.
Algunos centros optan por realizar una reparación completa en el período neonatal cuando hay obstrucción severa del TSVD, otros centros optan por realizar una intervención paliativa para realizar la reparación completa en una segunda etapa.
La paliación inicial permite asegurar un adecuado flujo pulmonar. Esto puede llevarse a cabo por medio de cirugía abierta (shunt de Blalock Taussig modificado (mBTS) o shunt central) o un procedimiento percutáneo en el laboratorio de hemodinamia (stent ductal o stent de TSVD).1
Otra presentación clínica incluye a los pacientes que tienen estenosis pulmonar leve. La fisiología es parecida a la de la CIV con shunt de izquierda a derecha y una saturación de oxígeno en los altos 90s. Estos pacientes tienen riesgo de hiperflujo pulmonar (Qp:Qs >1) y de falla cardíaca congestiva. Si la falla cardíaca congestiva está descompensada, el paciente puede cursar con infecciones respiratorias a repetición y retraso del crecimiento. En este caso el tratamiento incluye diuréticos. Eventualmente, la obstrucción del tracto de salida del ventrículo derecho se va a empeorar, las saturaciones de oxígeno disminuir, y va aparecer cianosis.
Los pacientes con TOF tienen riesgo de cursar con crisis cianóticas que se presentan como períodos de cianosis profunda secundarios a obstrucción dinámica severa del TSVD y shunt repentino de derecha a izquierda. Típicamente ocurren cuando un lactante se agita o en niños mayores no corregidos con el ejercicio vigoroso.
Factores desencadenantes incluyen la agitación, el dolor y el llanto que resulta en la activación del sistema nervioso simpático causando espasmo infundibular con obstrucción dinámica y aumento de la resistencia vascular pulmonar (RVP) en menor grado. Otros factores incluyen la deshidratación, la fiebre o vasodilatación, que disminuyen la resistencia vascular sistémica (RVS).
El tratamiento médico incluye posición genupectoral, oxigeno, volumen (suero fisiológico 10 a 20 ml/kg), sedación y eventualmente uso de beta-bloqueadores, por ejemplo el Propranolol para disminuir la contractilidad infundibular y disminuir la frecuencia cardíaca (y aumentar el tiempo de llenado diastólico).
Se debe optimizar el incremento ponderal, ya que la desnutrición y el bajo peso son factores de riesgo para la cirugía. Mucho de los pacientes con TOF pueden tener alteraciones genéticas asociadas, por ejemplo microdeleción 22q11.2 y trisomía 21, que dificultan el adecuado incremento de peso. Estos factores se deben tomar en consideración al evaluar estos pacientes. Los infantes con sintomatología leve pueden estar de sobrepeso porque son alimentados con mucha frecuencia para apaciguar el llanto y la agitación que podrían provocar hipoxemia.
La policitemia y acropaquia (dedos en palillo de tambor), figura 2, son manifestaciones de cianosis prolongada, tienen hiperviscosidad de la sangre con mayor riesgo trombótico y alteración de la coagulación por disminución proporcional de los factores de coagulación. Estos pacientes deben manejarse con hematocrito más alto que en pacientes no cianóticos.
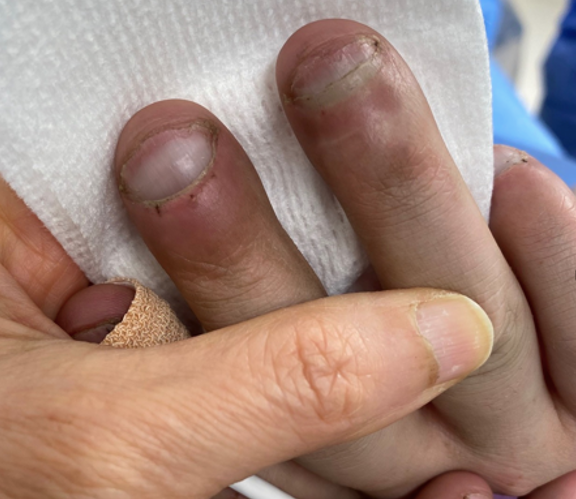
Figura 2. Acropaquia (dedos en palillo de tambor), comparados con dedo normal. Fotografía del autor.
Reparación quirúrgica
El objetivo de la reparación quirúrgica de la TOF con estenosis pulmonar es reestablecer el flujo sanguíneo pulmonar desobstruyendo el tracto de salida del ventrículo derecho y cerrar la CIV.1 Si es posible, se intenta conservar la válvula pulmonar nativa, y así preservar su función durante la reparación.
Cuando no es posible preservar la válvula debido a una morfología muy anormal o hipoplasia severa del anillo pulmonar, se agranda el infundíbulo mediante un parche transanular, resultando en insuficiencia pulmonar. Los abordajes quirúrgicos incluyen la vía transauricular, transpulmonar y ventricular. En ciertos casos puede ser necesario poner un conducto del ventrículo derecho a la arteria pulmonar, por ejemplo en casos de arterias coronarias anómalas cuyo trayecto cruza el ventrículo derecho y pueden ser lesionadas durante la ventriculotomía; la frecuencia de las arterias coronarias anómalas en TOF es de 5-12%.3,4
El momento para la reparación quirúrgica electiva varía dependiendo de las características del paciente y de las preferencias del hospital; típicamente desde recién nacidos hasta 4 a 6 meses de edad, siendo desde los 3 a 6 meses el período con menor riesgo quirúrgico y menos complicaciones producto del avance de la enfermedad. Retrasar el tiempo de la cirugía posterior al período de recién nacido, permite tiempo para el crecimiento somático, lo que mejora las condiciones técnicas para la reparación completa; este beneficio se logra a expensas de una exposición a la hipoxemia más prolongada y mayor hipertrofia ventricular derecha con el paso del tiempo.3,4
Comorbilidades y Síndromes asociados con TOF1,3,4,5
- Síndrome de microdeleción 22q11.2 (Síndrome de Digeorge, Síndrome velo-cardio-facial): aplasia o hipoplasia del timo e hipoplasia de las paratiroides con el consiguiente riesgo de inmunodeficiencia, hipocalcemia y vía aérea difícil por alteraciones craneofaciales
- Asociación VACTERL: Defectos vertebrales, atresia anal, anomalías cardíacas, fistula traqueoesofágica con atresia esofágica, displasia radial y renal, anomalías de las extremidades
- Trisomía 21: Anomalías cardíacas, retraso en el desarrollo, hipotiroidismo congénito, hipotonía, inestabilidad cervical
- Síndrome de Alagille: Escasez de conductos biliares, anomalías cardíacas, renal, esquelético (vértebras en mariposa), oftalmológico, y facial
Otras anomalías cardíacas: arco aórtico derecho, anomalías coronarias, válvula pulmonar bicúspide, estenosis del tronco de la arteria pulmonar y de las ramas pulmonares, retorno venoso pulmonar anómalo total o parcial, origen aberrante de la arteria subclavia, defecto del tabique auriculoventricular, y vena cava superior izquierda persistente.
Siendo la más frecuente el arco aórtico derecho en un 25% de los pacientes con TOF con ramificación en espejo de los vasos principales.
Las anomalías coronarias ocurren en el 5-12% de los pacientes con TOF, incluida una arteria descendente anterior izquierda que cruza el tracto de salida del ventrículo derecho. No detectarlas preoperatoriamente puede tener consecuencias fatales.
Evaluación Preanestésica4,5
- Evaluación de la anatomía del TOF, incluidas las arterias coronarias y otras anomalías cardíacas y extracardíacas asociadas
- Ecocardiografía: principalmente para establecer el grado de obstrucción del TSVD, además del nivel de la obstrucción, gradiente, colaterales, tamaño de arterias pulmonares, grado de hipertrofia de VD, anomalías coronarias y arco aórtico.
- Electrocardiograma
- Radiografía de tórax: clásicamente con corazón en forma de bota, y signos de hipoflujo pulmonar
- Cateterismo cardiaco o tomografía computarizada cardíaca: No es requisito habitualmente. Está indicado cuando existen dudas de la anatomía coronaria o colaterales aortopulmonares mayores
- Signos vitales (saturación de oxígeno basal en reposo y en episodios de cianosis), medicamentos, incremento ponderal, hospitalizaciones previas (enfermedades respiratorias), presencia de crisis cianóticas
- Examen físico: vía aérea, signos de falla cardíaca congestiva, cianosis, acropaquia. Examine los sitios de acceso vascular
- Discusión preoperatoria con los equipos de cirugía, cardiología, UCI sobre el abordaje quirúrgico previsto, los planes para la extubación temprana como la analgesia multimodal, anestesia regional, uso de bajas dosis de opioides, coadyuvantes y otras consideraciones perioperatorias relevantes específicas del paciente (por ejemplo, relacionadas con el síndrome)
- Discutir los riesgos y beneficios de anestesia con la familia. Verifique los deseos de resucitación y la opción para la oxigenación por membrana extracorpórea (ECMO), y obtenga el consentimiento informado para la transfusión de productos sanguíneos
- Laboratorios: Tipo y compatibilidad de sangre, hemograma completo, perfil metabólico, pruebas de coagulación incluyendo fibrinógeno basal
- Evitar el ayuno prolongado
Preparación para la cirugía4,5
- Vía aérea: Tubo endotraqueal
- Premedicación para aliviar la ansiedad y prevenir crisis cianóticas en pacientes de alto riesgo
- Inducción endovenosa (EV), versus inhalatoria, versus intramuscular (IM)
- La inducción EV permite una inducción controlada y un acceso venoso rápido disponible para la administración de fluidos EV y medicamentos vasoactivos. La desventaja es que la instalación puede ser difícil y dolorosa, y podría desencadenar una crisis. Por esto se recomienda premedicación previa, un ejemplo puede ser el uso de Midazolam + Ketamina vía oral 30 minutos previo al procedimiento
- La inducción inhalatoria facilita la colocación de vía EV en pacientes difíciles. La desventaja es que la vasodilatación excesiva puede promover el shunt de derecha a izquierda, además de agitación en la fase excitatoria de los halogenados. Por lo tanto, se deben titular los medicamentos para el efecto deseado mientras se controla la hemodinamia
- La inducción IM es una buena alternativa para facilitar la inducción en pacientes con acceso EV difícil e inducción inhalatoria de alto riesgo. La desventaja es el dolor en inyección y un inicio de acción más lento que la vía EV
- Medicamentos:
- Fenilefrina (2-10 mcg/kg bolo, y 1-5 mcg/kg/min infusion) para el tratamiento de los episodios de cianosis
- Infusiones vasoactivas: Para tratar la hipotensión durante el periodo pre-bypass, se prefiere vasopresina o fenilefrina en vez de epinefrina debido al posible empeoramiento de la obstrucción del tracto de salida del ventrículo derecho con la taquicardia que puede producir la epinefrina. Después del alivio quirúrgico adecuado de ello, se puede utilizar epinefrina como apoyo inotrópico
- Esmolol o Propranolol como inótropo y cronótopo negativo y disminución de la obstrucción del TSVD
- Vasodilatador como Nicardipina o Nitroprusiato de sodio, +/- esmolol en caso de hipertensión arterial postoperatoria
- Control del dolor y sedación multimodal: bolos e infusión de opioides, infusión de dexmedetomidina, ketamina, acetaminofeno EV y bloqueo de nervios regional
- Antifibrinolíticos (ácido tranexámico o ácido aminocaproico) en bolo +/- infusión contínua
- Heparina
- Protamina
- Calcio (cloruro or gluconato)
- Anestésico local para los sitios de incisión y/o bloqueo regional para el control del dolor posoperatorio
- Productos sanguíneos (irradiados): glóbulos rojos, plasma, crioprecipitado y plaquetas
Monitores/acceso vascular4,5
- Monitorización estándar (electrocardiograma de 5 derivaciones, frecuencia cardiaca, presión arterial no invasiva, capnografía, temperatura central y periférico), e invasiva (presión arterial invasiva, presión venosa central, espectroscopía de infrarrojo cercano (NIRS)
- Vías arterial y central: Evitar accesos femorales para futuros cateterismos y eventual instalación de válvula pulmonar percutánea
- Ecocardiografia transesofágica
- Sonda urinaria
- Via EV periférica
- Test viscoelásticos
General4,5
- Prevención de crisis cianóticas durante el período pre-bypass2,3
- Mitigar los factores desencadenantes como agitación, hipoxemia, hipercarbia, e hipovolemia que conducen al espasmo infundibular o disminución de la RVS
- FiO2 100% y ventilar con presiones bajas de vía aérea
- Evitar anestesia superficial y agitación, monitorizando disminución de RVS
- Posición de rodilla en el pecho o compresión abdominal (aumentar la presión venosa central y precarga para aumentar la RVS)
- Fenilefrina (2-10 mcg/kg bolo, 1-5 mcg/kg/min infusion) +/- esmolol (0,5-1 mg/kg bolo, 25-400 mcg/kg/min infusion) o Propranolol (0,01-0,1 mg/kg)
- Bolo de fluido endovenoso (eliminar el aire en la vía endovenosa para evitar una embolia gaseosa paradójica) 10 ml/kg
- Cuando todas estas medidas fallan y el paciente continúa deteriorándose, el cirujano debe abrir el tórax rápidamente, realizar compresión aórtica para aumentar RVS, y prepararse para iniciar bypass con urgencia
- Purgar meticulosamente las vías endovenosas para prevenir la embolia aérea.
Inducción de anestesia4,5
- Inducción por inhalación de gas anestésico, obtener vía EV periférica, inducción, utilizar relajo neuromuscular para realizar intubación endotraqueal
- Inducción por via endovenosa: ketamina IV (2 mg/kg), fentanilo (1-2 mcg/kg) y rocuronio u otro relajante neuromuscular (0,6 mg/kg) con cuidado de mantener una adecuada postcarga del ventrículo izquierdo
- Volemizar para mantener precarga adecuada
- Línea arterial y catéter venoso central post-inducción
- Inserción de sonda de ecocardiografía transesofágica
Mantención de anestesia4,5
- Agente inhalatorio, opioides endovenosos y sedación adyuvante (infusión de dexmedetomidina, 0,3 a 0,7 mcg/kg/h
- Metas hemodinámicas/fisiológicas:
- Reducir la hipoxemia2 manteniendo la postcarga y RVS para disminuir el shunt de derecha a izquierda y promover el flujo sanguíneo pulmonar
- Precarga adecuada para minimizar la obstrucción dinámica del tracto de salida del ventrículo derecho
- Evitar la hipoxemia, la hipercapnia y la acidosis
Consideraciones quirúrgicas intraoperatorias1
- Las coronarias aberrantes que cruzan el TSVD serán un impedimento a la ventriculotomía, y será necesario un conducto del ventrículo derecho a la arteria pulmonar
- En casos de alto riesgo, se deja una pequeña comunicación intraauricular para permitir la decompresión del ventrículo derecho.
- Después de la reparación quirúrgica se utiliza la ecocardiografía transesofágica para evaluar la presencia de CIV residual, los gradientes a través del TSVD, la función de la válvula pulmonar y la función ventricular
- La relación de la presión del ventrículo derecho al ventrículo izquierdo puede ayudar a determinar la condición de la reparación (menos de 0,5-0,75 se considera aceptable)
- Si hay dificultad para salir de la circulación extracorpórea, casi siempre hay un problema anatómico residual1
- Una complicación que se debe tener presente es el bloqueo auriculoventricular completo debido a la proximidad del sistema de conducción al parche para la CIV; hay que tener disponible un marcapasos transitorio con la configuración adecuada
- El bloqueo de rama derecha es común en el ECG después de la ventriculotomía1
- Hay una predisposición a taquicardia ectópica de la unión (JET) en el postoperatorio. Las medidas de tratamiento incluyen reducir el uso de drogas vasoactivas catecolaminérgicas, adecuada sedación, bajar la temperatura del paciente a 35ºC, uso de dexmedetomidina y amiodarona
Emergencia/Disposición4,5
- Sangrado después del bypass: Tratamiento con transfusiones de crioprecipitado o fibrinógeno liofilizado, plaquetas y plasma o concentrados protrombínicos según lo indiquen las pruebas viscoelásticas y disponibilidad del centro. El ventrículo derecho hipertrófico requiere fluidos y una precarga adecuada para mantener el gasto cardíaco
- Para tratar la disfunción del ventrículo derecho, se pueden considerar infusiones de dopamina, epinefrina y milrinona. La milrinona ayuda en caso de necesidad de vasodilatación. La medición de presión de la aurícula izquierda y derecha es útil en el manejo del volumen
- Infusión de beta-bloqueador como esmolol en caso de obstrucción residual o hipertensión post-reparación. Añadir un vasodilatador como nitroprusiato de sodio en infusión si es necesario para la hipertensión posterior a la reparación
- Idealmente realizar extubación precoz si el paciente se encuentra hemodinámicamente estable sin aumento de soporte y con sangrado mínimo2
- Anestésico local para los sitios de incisión y/o bloqueo regional para el control del dolor posoperatorio
- Cama UCI para cuidados posoperatorios
Posoperatoria4,5
- Traslado a UCI
- Analgesia (opioides, bloqueo regional) y sedación (infusión de dexmedetomidina)
- Si se dejó una comunicación intraauricular para permitir la decompresión del ventrículo derecho, la desaturación puede ser una indicación de disfunción del ventrículo derecho, obstrucción residual del TSVD, o incluso hipertensión pulmonar. El ecocardiograma Doppler es útil para diagnosticar la causa
- Para tratar la disfunción del ventrículo derecho, se considera infusiones de dopamina, epinefrina y milrinona. La milrinona ayuda en caso de necesidad de vasodilatación
- Infusión de beta-bloqueador como esmolol en caso de obstrucción residual o hipertensión post-reparación. Añadir un vasodilatador como nitroprusiato de sodio en infusión si es necesario para la hipertensión posterior a la reparación
Complicaciones3,4,5
- Arritmias: taquicardia ectópica de la unión, bloqueo AV completo3,4
- Lesiones residuales: CIV, obstrucción del TSVD, insuficiencia pulmonar es esperable causada por la reparación con parche transanular1
- Fisiología restrictiva del ventrículo derecho3,4
Preguntas
Responde preguntas aquí.
References
- Jonas A. Tetralogy of Fallot with pulmonary stenosis. In: Jonas A, ed. Comprehensive Surgical Management of Congenital Heart Disease. 2nd ed. Boca Raton, Florida: Taylor & Francis Group, LLC; 2014: 347-368.
- Van Praagh R. The first Stella van Praagh memorial lecture: the history and anatomy of tetralogy of Fallot. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2009;19-38. doi:10.1053/j.pcsu.2009.01.004 PubMed
- Wilson R, Ross O, Griksaitis MJ. Tetralogy of Fallot. BJA Educ. 2019;19(11):362-369. doi:10.1016/j.bjae.2019.07.003 PubMed
- Schmitz ML, Chau DF, Das RR, Thompson LL, Ullah S. Anesthesia for Right-sided Obstructive Lesions. In: Andropoulos DB, Mossad EM, Gottlieb EA, ed. Anesthesia for Congenital Heart Disease. 4th ed. Hoboken, NJ; Wiley-Blackwell. 2023: 674-709
- Wise-Faberowski L, Asija R, McElhinney DB. Tetralogy of Fallot: Everything you wanted to know but were afraid to ask. Paediatr Anaesth. 2019;29(5):475-482. PubMed
Copyright Information

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.