Copy link
Hernia Diafragmática Congénita
Last updated: 11/04/2024
Puntos Clave
- La hernia diafragmática congénita es un defecto en el diafragma a través del cual las vísceras abdominales entran en el tórax e interfieren con el crecimiento y desarrollo normal de los pulmones.
- El pronóstico de los pacientes depende en gran medida del grado de hipoplasia pulmonar y la presencia de otras anomalías congénitas asociadas. El manejo exitoso inicial de la hipertensión pulmonar es clave en la supervivencia de los pacientes afectados.
- El paciente debe ser llevado a sala de operaciones para corregir el defecto en el diafragma únicamente posterior a su estabilización médica inicial.
Introducción y Epidemiología
- La hernia diafragmática congénita (HDC) es un defecto en el diafragma a través del cual las vísceras abdominales entran en el tórax interfiriendo con el desarrollo normal de los pulmones.1
- La incidencia de esta patología es de 1/3000 nacidos vivos.2,3 Fue descrita por Bochdalek en 1848.4
- La diabetes gestacional y el consumo materno de alcohol pueden estar asociados con la ocurrencia de una HDC.3
- La consecuencia fundamental de esta patología es una hipoplasia pulmonar irreversible a causa de la compresión por las vísceras en el lado afectado.3,5
- La mitad de los casos de hernia diafragmática se asocian con otras anomalías congénitas como cardiopatías, anormalidades cromosómicas o defectos del tubo neural que suelen empeorar el pronóstico.3,5,6
- Los principales factores que influyen sobre el pronóstico son la presencia de cardiopatías congénitas, el grado de hipoplasia pulmonar y la presencia del hígado en la cavidad torácica.1
- A pesar de los avances en el manejo médico y quirúrgico de esta patología, la mortalidad actualmente es de 21-48%.5
Fisiopatología
Alteraciones Anatómicas
- El diafragma se forma entre las 4-8 semanas de gestación de cuatro precursores embrionarios. La falta de desarrollo normal de estos precursores es el origen embriológico de la HDC.5
- Existen 3 variantes anatómicas o defectos identificados para la HDC (Figura 1): el más común es un defecto posterolateral izquierdo del diafragma a través del foramen de Bochdalek (95%), el 80-85% de estos se presentan en el lado izquierdo y solo en un 2% de los casos son bilaterales. Menos comunes son el foramen de Morgagni en el cual el defecto es anterior o retroesternal y la hernia hiatal.7
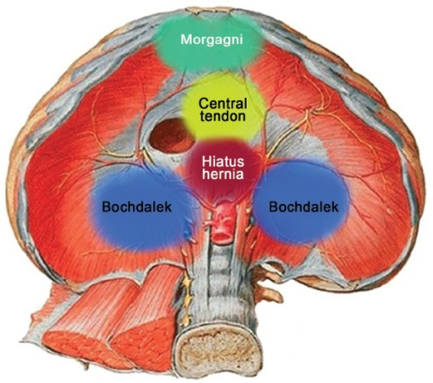
Figura 1. Representación esquemática de la hernia diafragmática anterior (Morgagni), posterolateral (Bochdalek) y central o hernia hiatal. Fuente: Open-i
Alteraciones Respiratorias
- La herniación del contenido intestinal a la cavidad abdominal se da durante las primeras semanas de gestación por lo que suelen existir grados variables de hipoplasia pulmonar en los pacientes.
- Se evidencia un pobre desarrollo del árbol traqueobronquial. Normalmente existen entre 23-35 ramificaciones bronquiales en pulmones de desarrollo normal, pero en este caso el pulmón afectado suele tener solo entre 12-14 divisiones y entre 16-18 el pulmón contralateral.6 Este fenómeno disminuye la superficie disponible para intercambio gaseoso.8
- Existe desviación del mediastino comprimiendo el pulmón contralateral potencialmente afectando también el desarrollo normal del otro pulmón.7
- En la vida postnatal, las asas intestinales herniadas se pueden llenar de aire y causar mayor compresión pulmonar, atelectasias y dificultad respiratoria por lo que el estado del paciente tiende a empeorar.6
Alteraciones Hemodinámicas
- Existe además alteración en el desarrollo de los vasos sanguíneos pulmonares con disminución en las ramas arteriales, remodelación vascular con hiperplasia de la capa media y aumento de la sensibilidad a los estímulos vasoconstrictores.3,6
- Lo anterior se traduce en persistencia de la circulación fetal con presencia de cortocircuitos derecha a izquierda a través de la permanencia del foramen oval y el conducto arterioso que resulta en hipoxemia, hipercapnia y acidosis neonatal.8
- Se ha identificado además una disfunción endotelial en la cual hay un aumento de secreción de sustancias vasoconstrictoras por parte el endotelio y aumento de la sensibilidad a estas por una mayor presencia de receptores a estas sustancias en el músculo liso vascular. La hiperinsuflación pulmonar por estrategias ventilatorias agresivas se ha visto asociado con intensificar este daño endotelial.7
- El desenlace es hipertensión pulmonar con sobrecarga y falla cardíaca derecha, asociado en algunos casos con hipoplasia del ventrículo izquierdo (Figura 2).
- La combinación de todos estos factores hace que la hipertensión pulmonar en estos pacientes sea de difícil manejo.1
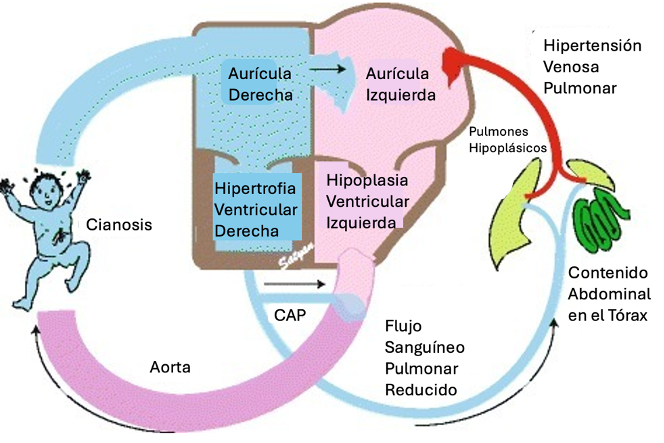
Figura 2. Efectos cardiovasculares de la HDC. CAP, Conducto Arterioso Persistente. Fuente: Open-i
Presentación y Diagnóstico
Presentación Clínica
- La tríada clásica consiste en: taquipnea, aparente dextrocardia y cianosis.1,7
- Clínicamente se manifiesta en un recién nacido con dificultad respiratoria de variable severidad, aleteo nasal, taquipnea, tiraje intercostal y cianosis.1,8
- Al examen físico se suele notar un abdomen excavado, disminución de los ruidos pulmonares en el hemitórax afectado y desplazamiento de los ruidos cardíacos a la derecha. Se auscultan ruidos digestivos en el lado de la hernia.1,3,6
Diagnóstico
- En la actualidad, el diagnóstico se realiza en el periodo prenatal mediante ecografía fetal de alta resolución. Los hallazgos típicos suelen ser la presencia de polihidramnios, burbuja gástrica e intestinos dentro de la cavidad torácica y desviación anormal del mediastino y el corazón.6,8
- Hay dos hallazgos prenatales importantes para el pronóstico: en primer lugar, la presencia del hígado dentro de la cavidad torácica disminuye la supervivencia por la mitad; en segundo lugar, en las semanas 24-26, se mide el índice cefálico-pulmonar, con el cual un índice <0.8 lleva un 100% de mortalidad.4
- La resonancia magnética prenatal permite valorar el volumen pulmonar, la posición del hígado y la masa ventricular izquierda.1,5
- El diagnóstico postnatal se realiza mediante una radiografía del tórax y el abdomen (Figura 3). Se observa característicamente a las asas intestinales ubicadas dentro de la cavidad torácica, el mediastino se encuentra desviado y si el paciente tiene una sonda nasogástrica colocada, se suele localizar la punta de esta situada en el tórax.6
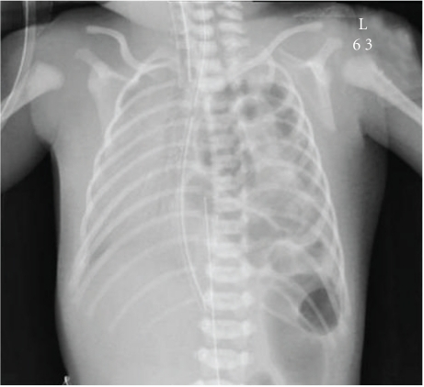
Figura 3. Rayos X de tórax mostrando una Hernia Diafragmática Congénita Izquierda con asas intestinales dentro del hemitórax izquierdo. Fuente: Open-i
Tratamiento
Manejo Prenatal
- En algunos centros se está realizando cirugía fetal para esta condición con resultados prometedores. El objetivo de los procedimientos fetales es mitigar el grado de hipoplasia pulmonar. El procedimiento, Oclusión Traqueal Endoscópica Fetal (FETO), consiste en la oclusión de la tráquea del feto con un balón que va a permitir que se acumule líquido dentro de los pulmones y genere suficiente presión para distender las vías aéreas y favorecer el desarrollo alveolar. El balón se debe remover previo al nacimiento.1,3,5
- A pesar de que la administración de esteroides prenatales o el uso de surfactante son estrategias importantes en el tratamiento de la inmadurez pulmonar, su beneficio no se ha demostrado en HDC.4
Manejo Postnatal
- Se trata de alcanzar un parto de al menos 37 semanas de gestación para evitar las complicaciones relacionadas con un parto prematuro. No existe evidencia de que el parto por cesárea ofrezca algún beneficio. La madre debe ser trasladada a un centro especializado donde se tiene experiencia en el manejo de este tipo de pacientes.1,5
- Después del nacimiento se debe colocar una sonda naso u orogástrica para descomprimir el estómago. La mayoría de estos pacientes van a requerir una intubación inmediata.3,9
- El manejo inicial exitoso de la hipertensión pulmonar el clave en la supervivencia del paciente.2
- Los objetivos gasométricos son: saturación preductal 85-95%, postductal >70%, hipercapnia permisiva de PaCO2 40-60mmHg y un pH>7.25. Si la ventilación es convencional se recomiendan parámetros ventilatorios “gentiles” como PIP <25cmH2O, PEEP 3-5cmH2O y frecuencia respiratoria de 40-60rpm.5
- Si no se logran alcanzar los objetivos gasométricos, se puede optar por cambiar a ventilación oscilatoria de alta frecuencia (HOFV).1
- El óxido nítrico inhalado (iNO) es el agente de primera línea para el manejo de la hipertensión pulmonar. El criterio para iniciarlo se basa en el índice de oxigenación (IO) que evalúa la severidad de la hipertensión pulmonar. Si el IO es mayor de 20, se sugiere iniciar el iNO. La dosis inicial es de 20PPM.1

- La milrinona, un inhibidor de la fosfodiesterasa 3, se utiliza en casos de HDC para el manejo de la hipertensión pulmonar refractaria al tratamiento con iNO. Su principal efecto adverso es la hipotensión por lo que se debe evitar utilizar una dosis de carga en pacientes con inestabilidad hemodinámica.
- El uso de oxigenación por membrana extracorpórea (ECMO) se reserva como el último recurso por estabilizar a los pacientes con deterioro progresivo o descompensación aguda a causa de su HDC. Las indicaciones respiratorias para iniciar ECMO son un IO elevado, presiones pico elevadas e hipercarbia refractaria. Las indicaciones cardíacas son un lactato persistentemente elevado, soporte inotrópico prolongado, arritmias y disfunción cardíaca severa.3
- El ECMO veno-arterial se utiliza comúnmente en pacientes con HDC para dar soporte a la función ventricular debido a la hipertensión pulmonar severa y apoyar el intercambio gaseoso causa de los pulmones hipoplásicos.3
Tratamiento Quirúrgico
- En el pasado, los pacientes con HDC se llevaban inmediatamente a quirófano para corrección quirúrgica de la hernia, pero esta práctica no se asociaba con los resultados esperados ya que el pulmón está hipoplásico y no solamente atelectásico. Actualmente, el paciente se lleva a quirófano de manera semi-electiva una vez alcanzada la estabilización médica.2
- El abordaje quirúrgico abierto consiste en la reducción de la hernia y cierre del defecto en el diafragma con un parche a través de un abordaje abdominal subcostal izquierdo (Figura 4).6
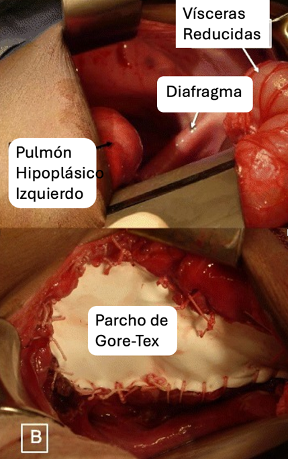
Figura 4. a) HDC izquierda mostrando el pulmón hipoplásico. b) Parcho protésico Gore-Tex para cerrar el defecto. Fuente: Open-i
- El abordaje mínimamente invasivo se realiza mediante toracoscopia izquierda. Este abordaje no permite readecuar las vísceras reducidas hacia abdomen lo que aumenta el riesgo de vólvulos en el postoperatorio.
- La corrección quirúrgica permite la reexpansión pulmonar sin embargo no suele haber una mejoría inmediata de la hipertensión pulmonar o de la hipoxemia.1,5
- En pacientes que no requieren ECMO, la reparación se realiza luego de 48-72 horas de vida y estabilización inicial. En paciente que requieren ECMO, la reparación es más temprana, dentro de las primeras 72 horas de vida.1
Consideraciones Anestésicas
Evaluación Preoperatoria
- La meta principal en el preoperatorio es optimizar la oxigenación y corregir el desequilibrio ácido-base. El paciente debe ser llevado a quirófano para corregir el defecto del diafragma únicamente cuando se haya estabilizado su hipertensión pulmonar, hipoxemia y acidosis que puede tardar varios días.6,8,9 Algunos definen estabilidad como estar libre de soporte inotrópico por al menos 24h.5
- Está indicado realizar un ecocardiograma para evaluar la función ventricular, estimar la presión en la arteria pulmonar, determinar la dirección del flujo a través del foramen oval
- el CAP y descartar la presencia de otras cardiopatías congénitas.3,5
- Un ultrasonido de cabeza también forma parte de la valoración preoperatoria ya que una hemorragia intracraneal es contraindicación para iniciar ECMO.3
- La mayoría de estos pacientes estarán intubados y bajo ventilación mecánica al momento de presentarse a sala de operaciones. En caso de que el paciente no esté intubado, se recomiendo planificar para una inducción de secuencia rápida.9
Manejo Intraoperatorio
- Los objetivos del manejo anestésico son: mitigar la respuesta adrenérgica al procedimiento, evitar el aumento en la resistencia vascular pulmonar (RVP) y reducir el cortocircuito de derecha a izquierda.
- Dependiendo de la severidad, en la gran mayoría de los casos se utiliza monitoreo invasivo.
- El acceso venoso debe ser adecuado para permitir una reanimación de volumen apropiada, transfusiones e infusión de inotrópicos. Un catéter venoso central resulta útil en este escenario. El acceso central debe ser infradiafragmático en caso de que exista la posibilidad de ECMO.3,5
- La colocación de dos pulsioxímetros, uno preductal y otro postductal, permiten la identificación temprana de un incremento en el cortocircuito de derecha a izquierda a causa de la hipertensión pulmonar.2
- Control meticuloso de la temperatura ya que la hipotermia exacerba la hipertensión pulmonar, se asocia con coagulopatías y alteración en el funcionamiento enzimático normal.
- En caso de que el paciente se presente a quirófano no intubado, al momento de la inducción se debe evitar la ventilación con presión positiva con mascarilla facial ya que puede distender el estómago que se encuentra intratorácico y deteriorar la oxigenación. En caso de ser necesario ventilar, se recomienda usar presiones mínimas.6
- La distención intratorácica de las vísceras huecas también ocasiona una reducción de la precarga cardíaca por compresión del corazón que resulta en inestabilidad hemodinámica.3
- Una estrategia anestésica con relajación muscular y opioides en altas dosis (fentanilo 20-50mcg/kg) brinda una analgesia óptima para evitar elevaciones en la RVP. Se evita el óxido nitroso, que puede distender los intestinos y empeorar la ventilación del paciente o dificultar el cierre quirúrgico.2,5,6
- Los anestésicos inhalados pueden inhibir el reflejo vasoconstrictor pulmonar hipóxico y causan fácilmente hipotensión en neonatos por lo que su uso debe ser con mucho cuidado.4
- Se utilizará anestesia total intravenosa (TIVA) en pacientes que se encuentren con HOFV o ECMO. En estas circunstancias, el procedimiento se realiza usualmente en la sala de cuidados intensivos neonatales.
- Si el paciente se encuentra con una modalidad ventilatoria convencional, se siguen las mismas metas ventilatorias que en el preoperatorio. El neumotórax contralateral es un peligro real y debe vigilarse constantemente y tratarse inmediatamente.10
- La hipercapnia permisiva permite usar menor volumen o presión para ventilar reduciendo así la incidencia de volutrauma y barotrauma.2
- Se debe tener una vigilancia estricta de la oxigenación y ventilación durante el cierre del abdomen ya que estos pacientes corren el riesgo de desarrollar un síndrome compartimental abdominal. Este se puede manifestar inicialmente como presiones inspiratorias pico elevadas y con signos de congestión venosa en los miembros inferiores.3,5
Manejo Postoperatorio
- La ventilación mecánica debe mantenerse en el postoperatorio por lo que el paciente va a permanecer intubado y ser trasladado a la sala de Cuidados Intensivos Neonatales.6
- La analgesia neuroaxial o regional está indicada solo en casos muy selectos de pacientes con muy buena función pulmonar y mínimas comorbilidades. En pacientes que estarán bajo ventilación mecánica prolongada, el riesgo del uso de catéteres neuroaxiales sobrepasa los potenciales beneficios.3
- El ECMO es una contraindicación a las técnicas neuroaxiales por la necesidad de anticoagulación sistémica.
Preguntas
Responde preguntas aquí.
References
- Cristiani F, Lauber C. Urgencias Neonatales. En: Cristiani F, Motta P, eds. Anestesia Pediátrica. BiblioMédica; 2022.
- Olbrecht V, Kang J, Litman R. General Surgery. In: Litman R, Ambardekar A, eds. Litman’s Basics of Pediatric Anesthesia. 3rd ed. Elsevier; 2022.
- Eastburn E, Muldowney B. Congenital diaphragmatic hernia. In: McCann M, Greco C, Matthes K, eds. Essentials of Anesthesia for Infants and Neonates. Cambridge University Press; 2018. doi:10.1017/9781107707016
- Morton N, Fairgrieve R, Moores A, Wallace E. Anesthesia for the full term and ex premature infant. In: Andropoulus D, Gregory G, eds. Gregory’s Pediatric Anesthesia. 6th ed. Wiley Blackwell; 2020.
- Cross K, Carachi P, Wilmhurst S. General and thoracoabdominal surgery including management of conjoined twins. In: Lerman J, ed. Neonatal Anesthesia, Second Edition. Springer International Publishing; 2023. doi:10.1007/978-3-031-25358-4
- Granados L, Bedoya J, Sarmiento G, Arenas R. Emergencias neonatales. In: Jaramillo J, Echeverry P, Gómez J, eds. Tratado de Anestesia Pediátrica. SCARE; 2015.
- Barnes S, Davis P, Brett C. Anesthesia for general surgery in neonates. In: Davis P, Franklyn C, eds. Smith’s Anesthesia for Infants and Children. 10th ed. Elsevier; 2022.
- Spaeth J, Lam J. The extremely premature infant (micropremie) and common neonatal emergencies. In: Coté CJ, Lerman J, Anderson BJ, eds. Coté and Lerman’s A Practice of Anesthesia for Infants and Children. 6th ed. Elsevier; 2019.
- Wall J, Albanese C, Claure R, Golianu B, Hammer G. Pediatric general surgery. In: Jaffe RA, Schmiesing CA, Golianu B, eds. Anesthesiologists Manual of Surgical Procedures. 5th ed. Wolters Kluwer; 2014.
- Lerman J, Coté CJ, Steward DJ, eds. General and thoraco-abdominal surgery. In: Manual of Pediatric Anesthesia. 7th ed. Springer; 2016.
Copyright Information

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.